碳青霉烯類耐藥革蘭陰性菌聯合藥敏試驗方法學、流程、優缺點和結果判讀(三)
7.4紙片擴散法
7.4.1常規紙片擴散法將含有定量抗菌藥物的紙片貼在已接種測試菌的瓊脂表面上,紙片中的藥物吸收瓊脂中的水分后向紙片周圍擴散,隨著擴散距離的增加抗菌藥物的濃度呈對數減少,在紙片的周圍形成遞減濃度梯度。在紙片周圍抑菌濃度范圍內的測試菌不能生長,而抑菌濃度范圍外的菌株則繼續生長,從而在紙片的周圍形成抑菌圈。操作時將兩張不同抗菌藥物的藥敏紙片以一定的距離放置,參考距離為一張紙片的邊緣距離另外一張紙片的抑菌圈邊緣3~4 mm。經過孵育后根據兩藥間的抑菌圈擴大或縮小等現象,判斷兩藥是否存在協同、相加、無關或拮抗現象(圖7和圖8)。紙片擴散法具有操作簡單且價格低廉的特點,但缺點是結果不易閱讀。紙片擴散法聯合藥敏試驗兩藥敏紙片的距離可參考圖8。若常規紙片擴散法聯合藥敏試驗結果模糊,難以判斷,建議使用其他方法(如肉湯微量稀釋棋盤法、紙條法)進行確認。
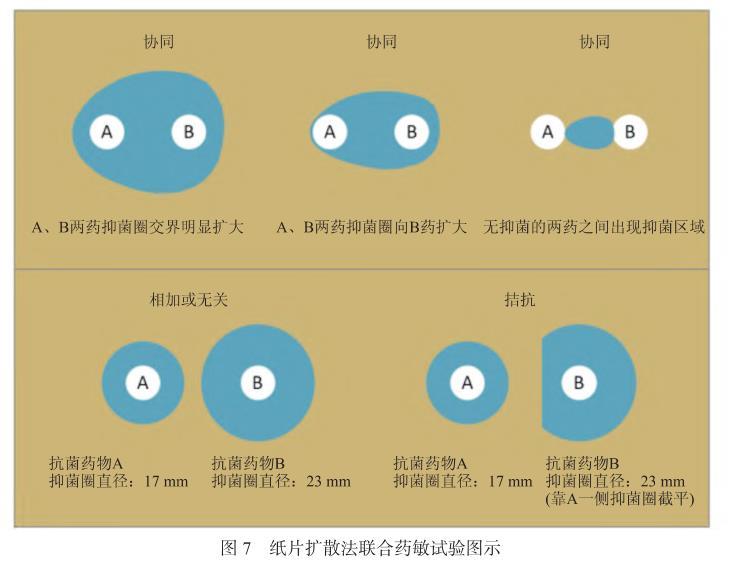
圖7紙片擴散法聯合藥敏試驗圖示
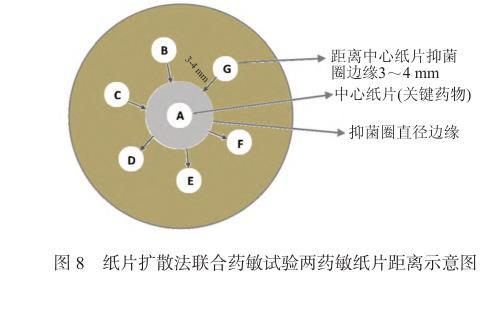
圖8紙片擴散法聯合藥敏試驗兩藥敏紙片距離示意圖
優先選擇敏感的抗菌藥物A作為關鍵藥物與其他抗菌藥物進行聯合,如頭孢他啶-阿維巴坦、替加環素或多黏菌素。
7.4.2紙片優加法紙片優加法[32]為常規紙片擴散法的改良方法。實驗時按圖示先將2張含抗菌藥物A單藥和1張含抗菌藥物B單藥紙片貼在已接種菌液的MH瓊脂表面,3張紙片間的中心距離為25 mm。放置30 min后,待紙片中的抗菌藥物完全滲透入瓊脂中后,按圖示移去一張A紙片,再在相同的位置上覆蓋貼上抗菌藥物B單藥紙片。經孵育后閱讀抑菌圈直徑,見圖9。
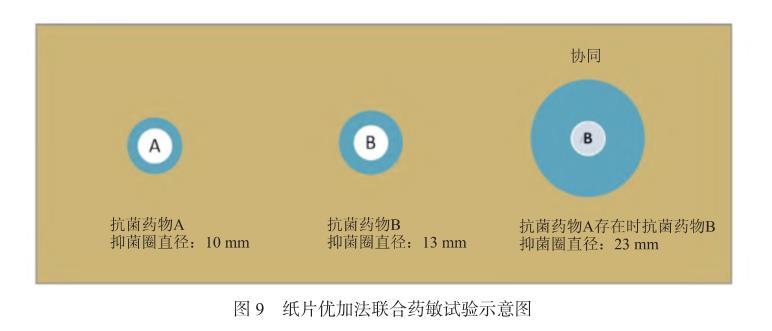
圖9紙片優加法聯合藥敏試驗示意圖
專家共識八:兩藥協同定義為抗菌藥物A和抗菌藥物B單藥均為耐藥,但抗菌藥物B在抗菌藥物A存在時表現為敏感或中介(即兩藥聯合的抑菌圈直徑明顯大于任何單藥抑菌圈直徑)。
7.4.3改良紙片優加法本方法與紙片優加法原理相似,目的為增加有效抗菌藥物的含量,達到加大劑量實現抑菌或殺菌的目的,如常可用此法增加頭孢哌酮-舒巴坦對CRAB的抗菌活性。操作方法同常規紙片擴散法,唯一的不同之處為多張同一抗菌藥物紙片緊鄰貼在一起,以實現該區域該抗菌藥物濃度加量的目的。由于舒巴坦對鮑曼不動桿菌存在殺菌活性,增加舒巴坦劑量可明顯提高鮑曼不動桿菌對頭孢哌酮-舒巴坦的敏感率[22],可嘗試以頭孢哌酮-舒巴坦為基礎聯合舒巴坦的聯合藥敏試驗方案。見圖10。
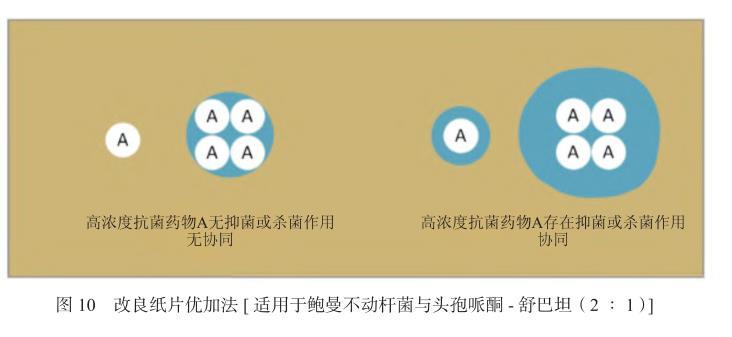
圖10改良紙片優加法[適用于鮑曼不動桿菌與頭孢哌酮-舒巴坦(2∶1)]
7.4.4肉湯紙片洗脫法肉湯紙片洗脫法[32]為改良肉湯稀釋法,包括兩種方法。
①常規肉湯紙片洗脫法:此方法為兩種不同抗菌藥物的聯合。實驗時在4根無菌試管中分別加入2 mL的CAMHB肉湯,分別標記為C、A、B和A+B管,其中C管為生長對照,A管放入1張抗菌藥物A藥敏紙片,B管放入1張抗菌藥物B藥敏紙片,A+B管同時放入抗菌藥物A和抗菌藥物B藥敏紙片,輕輕渦旋30 s,室溫(23±2)℃孵育至少30 min使紙片中的抗菌藥物完全擴散入肉湯中(不可超過60 min)(參考CLSI黏菌素肉湯紙片洗脫試驗)[35]。然后準備0.5麥氏濁度待測菌菌懸液,用移液器分別在在C、A、B和A+B管中加入10μL的0.5麥氏濁度待測菌菌懸液,最終接種菌量為7.5×105CFU/mL,35℃孵育16~20 h后觀察各管中的細菌生長情況(圖11)。注意:本方法每試管中肉湯的體積需按每片藥敏紙片中所含抗菌藥物的量和該菌對該抗菌藥物的耐藥判斷標準而定,溶液中抗菌藥物最終濃度應≥中介標準。如該菌對抗菌藥物的耐藥標準為≥16 mg/L,藥敏紙片中所含抗菌藥物的量為30μg/片,則每管中CAMHB肉湯的含量應為2 mL。以紙片中抗菌藥物完全溶解入肉湯中計算,2 mL肉湯中該抗菌藥物的濃度為15 mg/L(近似于耐藥標準)。

圖11常規肉湯紙片洗脫法示意圖
專家共識九:若C、A和B管中細菌均生長,但A+B管無細菌生長,報告抗菌藥物A和抗菌藥物B聯合“存在協同作用”。
專家共識十:若C、A、B和A+B管中的細菌均生長,報告抗菌藥物A和抗菌藥物B“不存在協同作用”。
舉例:如該菌為產金屬酶肺炎克雷伯菌,抗菌藥物A所含藥物為頭孢他啶-阿維巴坦,抗菌藥物B所含藥物為氨曲南。結果顯示單藥時細菌均生長,但兩藥聯合后細菌生長被抑制,呈現協同抑菌或殺菌作用。
②改良肉湯紙片洗脫法:此方法為單種抗菌藥物增加劑量的試驗。實驗時在4根無菌試管中分別加入2 mL的CAMHB肉湯,分別標記為C、A、A×2和A×3,其中C管為生長對照,A管放入1張抗菌藥物A藥敏紙片,A×2管放入2張抗菌藥物A藥敏紙片,A×3管放入3張抗菌藥物A藥敏紙片,輕輕渦旋,室溫孵育至少30 min使紙片中的抗菌藥物完全擴散入肉湯中(不可超過60 min)(參考CLSI黏菌素肉湯紙片洗脫試驗)[35]。然后吸取10μL的0.5麥氏濁度待測菌菌懸液分別加入C、A、A×2和A×3管中,最終接種菌量為7.5×105CFU/mL,35℃孵育16~20 h后觀察各管中的細菌生長情況(圖12)。注意:本方法每試管中肉湯的體積需按每片藥敏紙片中所含抗菌藥物的量和該菌對該抗菌藥物的耐藥判斷標準而定,溶液中抗菌藥物最終濃度應≥中介標準。如該菌對抗菌藥物的耐藥標準為≥16 mg/L,藥敏紙片中所含抗菌藥物的量為30μg/片,則每管中CAMHB肉湯的含量應為2 mL。以紙片中抗菌藥物完全溶解入肉湯中計算,2 mL肉湯中該抗菌藥物的濃度為15 mg/L(近似于耐藥標準)。
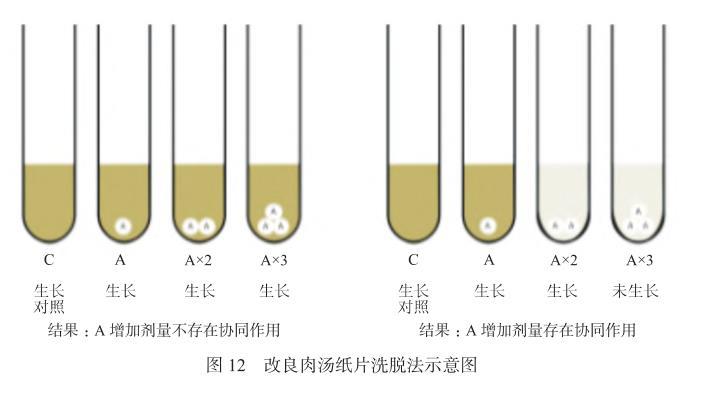
圖12改良肉湯紙片洗脫法示意圖
專家共識十一:若C和A管細菌均生長,但A×2和A×3管細菌均未生長,報告抗菌藥物A增加劑量“存在協同作用”。
專家共識十二:若C、A、A×2和A×3管細菌均生長,報告抗菌藥物A增加劑量“無協同作用”。
7.5聯合殺菌曲線[16-17,24,36-37]
通過檢測暴露于單藥或聯合藥物不同時間段時的細菌存活數,評估不同藥物間的協同或拮抗作用(圖13)。協同通常定義為:與最具抗菌活性的單藥相比,聯合用藥后細菌數呈≥2 log10CFU/mL級別的下降;拮抗通常定義為:與最具抗菌活性的單藥相比,聯合用藥后細菌數呈≥2 log10CFU/mL級別的上升。
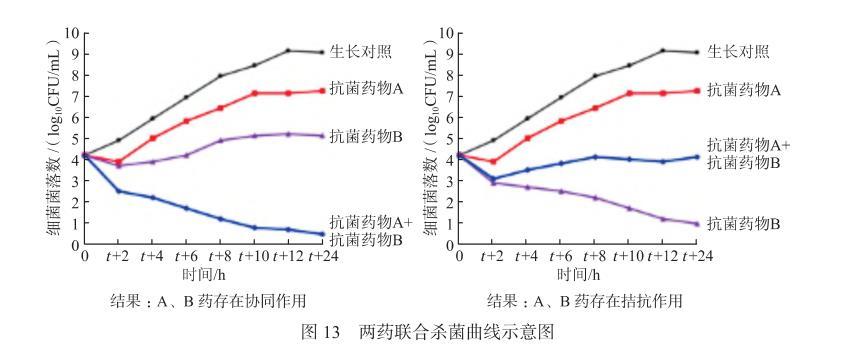
圖13兩藥聯合殺菌曲線示意圖
8聯合藥敏試驗結果報告及相關注釋
不同聯合藥敏試驗方法所得結果,報告格式略有差異。
以出現協同作用為例,當采用金標準方法進行聯合藥敏試驗時,若抗菌藥物A和抗菌藥物B兩藥呈現協同作用,可報告:抗菌藥物A和抗菌藥物B聯合存在協同作用。當采用非金標準方法進行聯合藥敏試驗時,若抗菌藥物A和抗菌藥物B兩藥呈現協同作用,可報告:抗菌藥物A和抗菌藥物B聯合可能存在協同作用。
專家共識十三:采用肉湯微量稀釋棋盤法及紙條交叉法聯合藥敏試驗,可根據FIC指數判斷兩藥協同、相加、無關和拮抗結果。若采用其他方法開展聯合藥敏試驗,僅根據結果報告兩藥是否存在協同作用。見圖14、圖15。
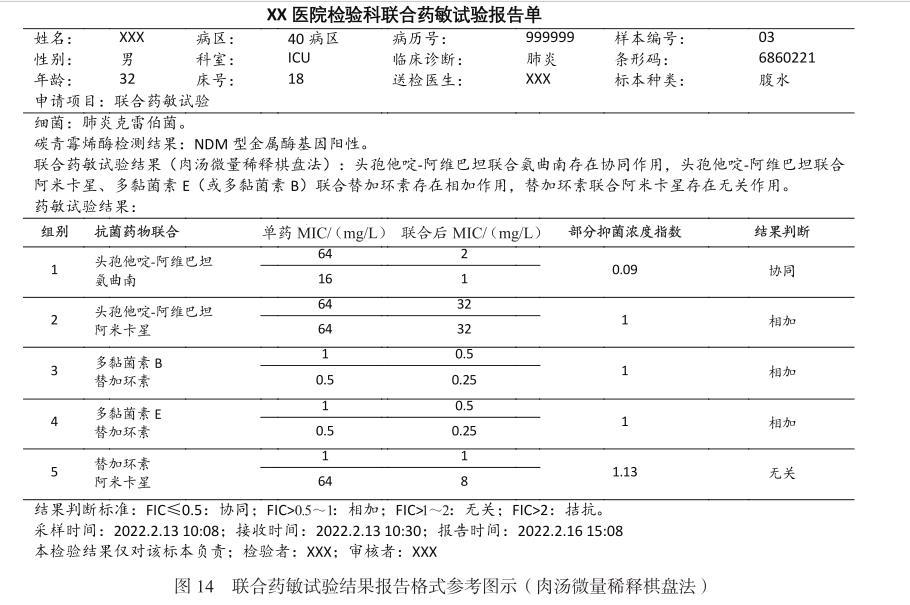
圖14聯合藥敏試驗結果報告格式參考圖示(肉湯微量稀釋棋盤法)

圖15聯合藥敏試驗結果報告格式參考圖示(紙片洗脫法)
9質量控制
目前國際上無專用的聯合藥敏試驗質量控制要求,建議可按照CLSI文件推薦的稀釋法(MIC測定)或紙片擴散法的質控要求[35],規范聯合藥敏試驗所涉及的稀釋法和紙片擴散法等重要方法學的操作步驟、材料、試劑和質控菌株的要求進行質控,各實驗室宜根據自己實驗室的條件,針對所選擇的聯合藥敏方法進行質量控制或性能驗證,僅在所有涉及的聯合藥敏試驗環節均在控的前提下,方可開展聯合藥敏試驗。
相關新聞推薦
1、不同磁化水處理對有益微生物(苜蓿根瘤菌)生長及功能的影響——討論及結論
3、不同涂布方法與平板放置時間對乳酸菌的平板菌落計數法的影響
